Aprobado en Europa. La compañía espera que también la FDA estadounidense dé el visto bueno a la comercialización de su fármaco
Europa da luz verde a la salida al mercado de secukinumab, de Novartis, en psoriasis
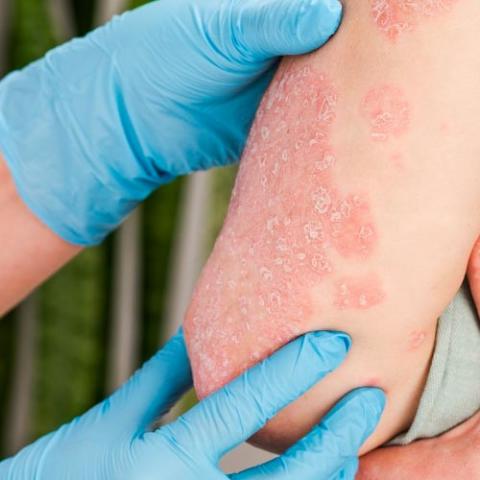
La multinacional suiza Novartis ha anunciado que la Comisión Europea ha aprobado secukinumab (Consentyx, antes conocido como AIN457), como tratamiento sistémico de primera línea para tratar la psoriasis en placas moderada / grave en adultos que son candidatos a un tratamiento sistémico.
Según la compañía, este fármaco, a una dosis de 300 mg, es el primer y único inhibidor de la interleuquina-17A (IL-17A) aprobado en Europa; dicha aprobación supone un hito importante para tratar la psoriasis, ya que les ofrece a los pacientes una nueva e importante alternativa de tratamiento biológico en primea línea. Actualmente, todos los tratamientos biológicos para la psoriasis, como las terapias anti-factor de necrosis tumoral (anti-TNF) y ustekinumab, se recomiendan como tratamientos sistémicos de segunda línea en Europa.
“Con estas revolucionarias noticias de la Comisión Europea, el blanqueamiento de la piel puede ser una realidad para los pacientes con psoriasis”, anunció David Epstein, jefe de la División de Pharmaceuticals de Novartis. “Casi la mitad de los pacientes con psoriasis no están satisfechos con las terapias actuales, incluyendo los tratamientos biológicos, lo que supone una importante necesidad no cubierta. Cosentyx, con una indicación sistémica de primera línea para tratar la psoriasis, ofrecerá a los pacientes una mejor opción para lograr un blanqueamiento total o casi total de la piel”.
El principal objetivo de tratamiento de los pacientes con psoriasis es blanquear la piel. En estudios clínicos, el 70 por ciento o más de los pacientes tratados con Cosentyx 300 mg logró un blanqueamiento total (PASI 100) o casi total (PASI 90) de la piel en las 16 primeras semanas de tratamiento; esto se mantuvo con tratamiento continuado en la mayoría de los pacientes hasta la semana 52. Los datos del programa de ensayos clínicos de Cosentyx también demostraron una relación positiva significativa entre lograr un blanqueamiento total o casi total de la piel y la calidad de vida asociada a la salud de los pacientes con psoriasis.
La aprobación de la UE sigue los últimos resultados del estudio CLEAR de Fase IIIb, que demostró que Cosentyx era superior a Stelara para blanquear la piel de los pacientes que padecen psoriasis en placas moderada / grave. El estudio CLEAR fue el segundo estudio comparativo de Cosentyx. Cosentyx también demostró su superioridad frente a etanercept (Enbrel) para blanquear la piel en el estudio Fixture. En el programa clínico de Fase III, el perfil global de seguridad de Cosentyx fue favorable, con mínimas diferencias entre las comparaciones directas con etanercept y ustekinumab.
Además de la UE, Cosentyx se ha aprobado en Australia para tratar la psoriasis en placas moderada / grave y en Japón para tratar la psoriasis en placas moderada / grave y la artritis psoriásica (AP) activa.
Por otra parte, la compañía espera que la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) de Estados Unidos dé el visto bueno para este fármaco en psoriasis en placas moderada / grave, un acontecimiento se prevé para principios de 2015 tras la recomendación de aprobación unánime emitida en octubre de 2014 por el Comité Asesor de Medicamentos Dermatológicos y Oftalmológicos (Dodac, por sus siglas en inglés) de la FDA de EE.UU.
Leé la noticia aquí: http://www.redaccionmedica.com/secciones/industria/europa-da-luz-ver-a-la-salida-al-mercado-de-secukinumab-de-novartis-en-psoriasis-2086