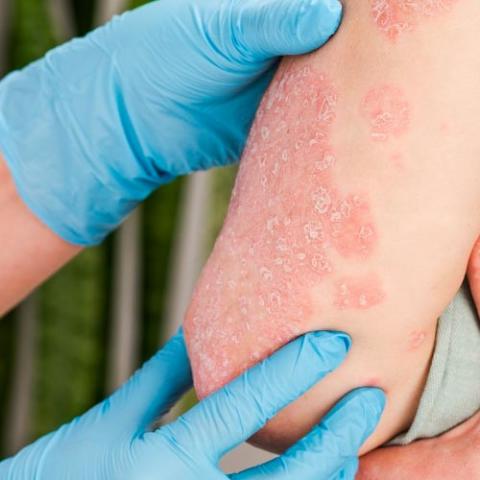
En los últimos años, los conocimientos en la fisiopatología de la psoriasis han experimentado un increíble avance. Dicho avance ha permitido el desarrollo de nuevos fármacos, que actúan de manera más específica, con el objetivo de mejorar la efectividad y disminuir los eventos indeseables de los tratamientos convencionales ya existentes. Es importante tener en cuenta que la práctica médica habitual no es sinónimo de investigación (aunque no necesariamente van por carriles separados). El propósito principal de la práctica médica es cuidar la salud y el bienestar de los pacientes, mientras que en investigación, el principal objetivo es probar nuevas ideas científicas o nuevos tratamientos.
Innovación en Psoriasis: una constante cientÃfica

Para que un nuevo fármaco o tratamiento pueda utilizarse en los pacientes requiere una rigurosa investigación que implica varias etapas y la posterior aprobación por la agencia regulatoria de cada país (ANMAT en Argentina). La Argentina ha participado, con muchos pacientes, en el desarrollo de varios fármacos para la psoriasis durante los últimos años. Sin embargo en nuestro medio muchas veces existe un gran prejuicio acerca de si participar o no de un ensayo clínico. Es importante conocer que la participación en un estudio clínico es voluntaria (pudiendo el paciente retirarse en cualquier momento y por cualquier razón) y que durante su ejecución los pacientes están muy controlados y se toman todos los recaudos para minimizar los riesgos potenciales.
Etapas de la investigación clínica
Estudios pre clínicos: investigaciones realizadas en animales de experimentación cuyo principal objetivo es responder preguntas básicas sobre seguridad de la droga. Una vez que el fármaco ha mostrado ser seguro en modelos animales pasa a ser probado en seres humanos e ingresa en la siguiente etapa que es la de los ensayos clínicos. Los investigadores diseñan los estudios clínicos con el objeto de responder preguntas específicas relacionadas a un producto o procedimiento médico y arman el plan de estudio al que se denomina “protocolo”. En el protocolo se detallan las características de los pacientes que pueden participar, número de pacientes, duración del estudio, países participantes, si el fármaco va a ser testeado contra placebo (sustancia de igual aspecto pero sin la medicación en estudio), etc.
Ensayos clínicos: en esta etapa el fármaco o tratamiento debe superar varias fases, con objetivos definidos y cada vez con mayor número de pacientes. Los estudios de Fase 1, 2 y 3 se realizan sin que el fármaco o tratamiento haya sido aprobado para su comercialización.Si los estudios cumplen los objetivos propuestos en estas etapas (se calcula que menos del 10% de los tratamientos superan todas las fases), las empresas farmacéuticas presentan sus resultados a las agencias sanitarias para que los evalúen y si pasan esta evaluación serán aprobados para su uso en los pacientes y comercialización.
En la actualidad, se considera que un estudio clínico es más robusto si ni el paciente ni el médico tratante saben a qué grupo (fármaco o placebo) pertenece el paciente, denominándose esta modalidad como estudios clínicos doble ciego. Los estudios de Fase 4 comprenden aquellos estudios que se realizan una vez que el fármaco fue aprobado y su principal objetivo es evaluar seguridad a largo plazo. En resumen, la investigación clínica implica una relación y compromiso entre la industria farmacéutica, el equipo de investigación y los pacientes, en pos de mejorar la salud y calidad de vida de éstos últimos.
*Especialista Universitario en Dermatología - Docente Adscripto de Dermatología, UBA - Experto en Psoriasis y artritis psoriásica, SOLAPSO - Investigador Principal en estudios clínicos de Psoriasis